La génétique médicale est entrée dans l’ère de la médecine génomique depuis l’accessibilité au séquençage à très haut débit. Ces progrès technologiques permettent de lutter contre l’impasse diagnostique et offrent la possibilité d’apporter un conseil génétique à de plus nombreuses familles. La demande de consultations de conseil génétique est croissante et le sera de plus en plus à l’avenir où se profilent des projets de dépistage génétique en population générale. Le médecin traitant aura un rôle essentiel d’information, d’orientation et de prévention sur les questions de génétique auprès de ses patients.
Introduction
La génétique médicale est une discipline relativement récente, en plein essor. Les patients reçus en consultation de génétique présentent très majoritairement une maladie rare qui atteint moins d’une personne sur 2000 (Figure 1). Les Plans maladies rares ont permis la création de 23 filières maladies rares regroupant l’ensemble des Centres de référence et de compétences maladies rares1. Établir le diagnostic peut être difficile, mais est pourtant indispensable afin d’adapter la prise en charge du patient et apporter un conseil génétique fiable, c’est-à-dire informer sur le risque de récurrence pour un couple ou identifier les personnes concernées dans une famille. Suivant la pathologie, le diagnostic génétique est posé soit cliniquement, soit par l’identification d’une anomalie chromosomique ou moléculaire chez les patients après un prélèvement sanguin.
Le développement récent du séquençage à très haut débit, qui permet de séquencer de nombreux gènes en même temps (panel), voire le génome entier d’un individu à un coût de plus en plus bas, a permis de rendre accessibles ces analyses en diagnostic. Le Plan France médecine génomique 2025 (PFMG)2 a été mis en place notamment pour réduire l’impasse diagnostique dans le champ des maladies rares, mais aussi dans le domaine de l’oncologie et de l’oncogénétique où la prise en charge thérapeutique du patient va dépendre des résultats de l’analyse du génome. Prochainement, de telles études seront proposées pour des maladies complexes comme certains types de diabète.

Figure 1 : Supports concernant les spécificités de la consultation de génétique.
Spécificités de la consultation de génétique
Encadrement légal et éthique
Les caractéristiques génétiques d’une personne ont la particularité d’être définitives et les résultats des analyses génétiques ont potentiellement des conséquences pour l’individu lui-même, mais aussi pour les membres de sa famille et sa descendance. Les données génétiques sont classées dans les catégories particulières de données à caractère personnel par le Règlement général sur la protection des données (RGPD)3 et l’examen des caractéristiques génétiques est encadré sur le plan légal par le Code de la santé publique (CSP)4 et par la loi de bioéthique5.
Définition du conseil génétique
Le conseil génétique consiste à évaluer (i) pour un couple, le risque d’avoir un enfant atteint d’une maladie génétique ou d’avoir transmis à sa descendance une anomalie génétique ou (ii) pour une personne, son risque de développer une maladie génétique (diagnostic présymptomatique), en cas d’antécédents familiaux connus. La consultation de conseil génétique doit avoir lieu dans le cadre d’une consultation individuelle. Elle a pour but d’accompagner les personnes concernées par une maladie génétique dans leur entourage, afin de les informer, de façon claire, des possibilités de prévention et de traitements, le cas échéant. Un arbre généalogique est établi afin de déterminer le lien de parenté avec la personne concernée par la maladie génétique pour pouvoir expliquer ensuite le mode de transmission et donner un risque théorique au consultant d’être porteur de l’anomalie génétique familiale (Figure 2).
Le professionnel de santé peut être amené ensuite à prescrire un examen des caractéristiques génétiques, après recueil du consentement libre et éclairé du consultant, donné par écrit. La communication du résultat est réalisée par le prescripteur au patient, de façon claire et appropriée, avec remise d’une copie du résultat. Le patient est informé de la législation concernant l’information à la parentèle.
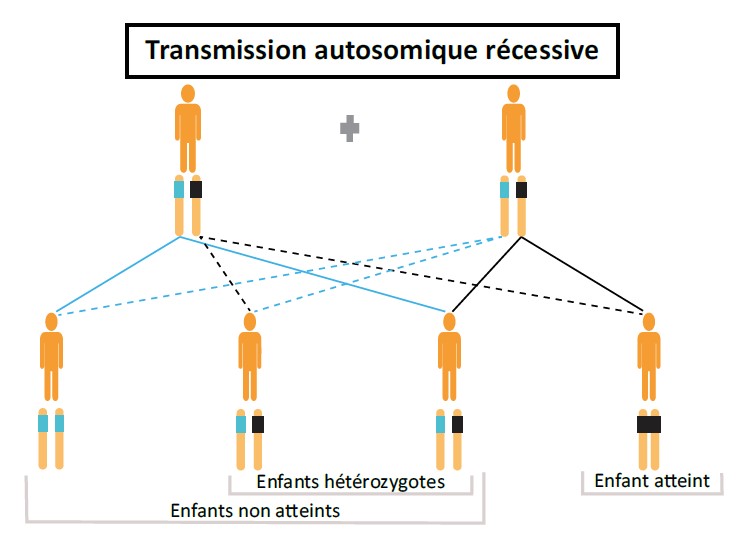
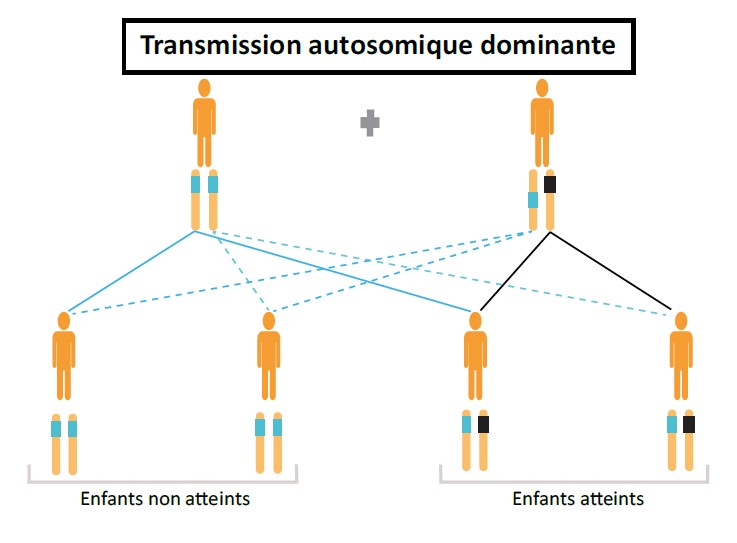
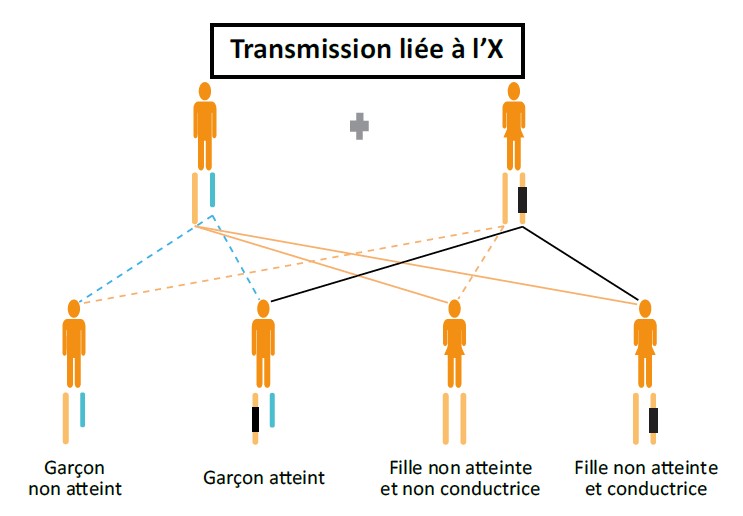
Figure 2 : Trois principaux modes de transmission de maladies génétiques.
Conseillers en génétique
La majorité des consultations de conseil génétique sont réalisées au sein d’un service de génétique clinique dans les centres hospitaliers publics ou privés. Elles sont très souvent réalisées par des conseillers en génétique sous la responsabilité d’un médecin qualifié en génétique, au sein d’une équipe pluridisciplinaire. Ces professionnels sont autorisés à prescrire et communiquer les résultats pour certains examens (biologie moléculaire et cytogénétique). Leur exercice est encadré par le CSP6.
Un médecin non généticien peut également prescrire l’examen des caractéristiques génétiques à condition qu’il connaisse la situation clinique, les conséquences familiales, soit capable d’en interpréter le résultat et travaille en relation avec une équipe de génétique clinique. Le prescripteur doit être capable de délivrer au patient une information préalable, complète et compréhensible.
Qui adresser en consultation de conseil génétique ?
Contexte de projet parental
Le conseil génétique est primordial dans le cadre d’un projet parental avec antécédents familiaux de maladie génétique. Il est fréquent que des couples nous soient adressés en cours de grossesse par le gynécologue ou la sage-femme. Cette situation d’urgence est anxiogène pour le couple et inconfortable pour l’organisation des examens et du conseil. En particulier, le couple doit faire en urgence des choix concernant le diagnostic et éventuellement une interruption médicale de grossesse.
Il est préférable que le conseil génétique soit effectué en période préconceptionnelle. D’une part, car le plus souvent les analyses génétiques permettent de rassurer les couples et d’envisager sereinement une grossesse. Et d’autre part, à l’inverse s’il existe un risque de transmission d’une pathologie, ils ont le temps de réfléchir et choisir les modalités de diagnostic – diagnostic prénatal (DPN), diagnostic prénatal non invasif (DPNI), diagnostic préimplantatoire (DPI) – ou le don de gamètes ou d’embryons.
Le recours à un DPN/DPNI ou DPI est proposé lorsqu’il existe une « forte probabilité que l’enfant à naître soit atteint d’une affection d’une particulière gravité réputée comme incurable au moment du diagnostic »7. Il n’existe pas de liste établie de pathologies. Chaque situation est discutée au cas par cas au sein du CPDPN (centre pluridisciplinaire de diagnostic prénatal). Chaque CPDPN est libre de sa décision qui peut nécessiter plusieurs semaines. Il est donc important que les demandes soient présentées en amont d’une grossesse. Les différentes options proposées aux couples sont (Figure 3) :
En cas de grossesse spontanée
Le diagnostic prénatal. Généralement, après une biopsie de trophoblaste (à partir de 12 semaines d’aménorrhée) qui présente un risque de fausse-couche évalué à 0,2 % environ. Pour les pathologies liées au chromosome X, un diagnostic de sexe foetal par prise de sang maternel peut être proposé auparavant. Le diagnostic prénatal non invasif, par étude de l’ADN foetal circulant à partir d’un prélèvement de sang maternel. Il nécessite la mise au point technique préalable donc nécessite une consultation avant le projet de grossesse. Actuellement, il concerne des maladies pour lesquelles le matériel génétique du foetus peut être distingué de celui de sa mère : maladies autosomiques dominantes transmises par le père, maladies autosomiques récessives pour lesquelles le père est porteur d’un variant différent de celui de la mère et couples ayant un enfant présentant une anomalie survenue de novo.
Le diagnostic prénatal non invasif, par étude de l’ADN foetal circulant à partir d’un prélèvement de sang maternel. Il nécessite la mise au point technique préalable donc nécessite une consultation avant le projet de grossesse. Actuellement, il concerne des maladies pour lesquelles le matériel génétique du foetus peut être distingué de celui de sa mère : maladies autosomiques dominantes transmises par le père, maladies autosomiques récessives pour lesquelles le père est porteur d’un variant différent de celui de la mère et couples ayant un enfant présentant une anomalie survenue de novo.
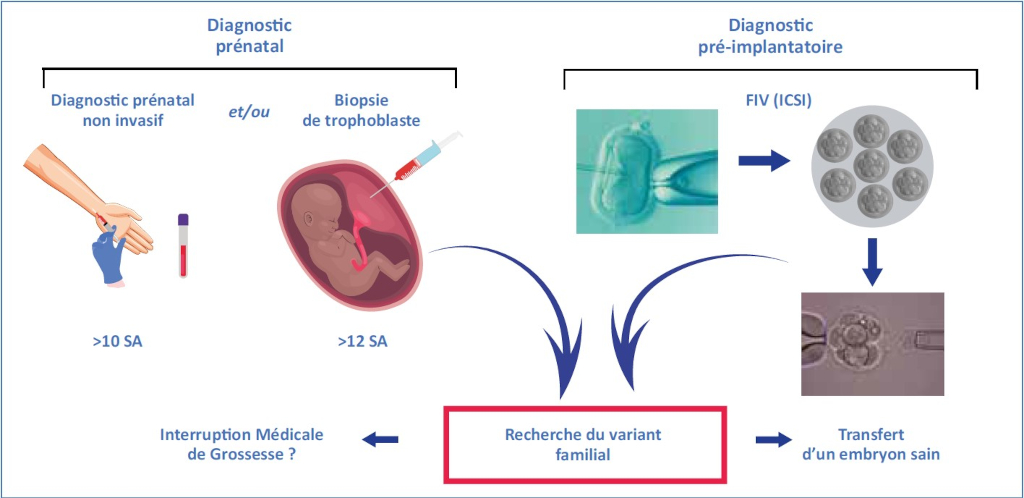
Figure 3 : Diagnostic prénatal et diagnostic préimplantatoire.
Le diagnostic préimplantatoire (DPI) nécessite une fécondation in vitro (FIV) à partir des gamètes du couple. Après 3 à 5 jours de développement embryonnaire, 1 ou 2 cellules sont prélevées et analysées. Il n’est pratiqué que par cinq centres en France (Grenoble, Montpellier, Nantes, Paris et Strasbourg). Les délais sont longs, environ 12 à 24 mois. Cette prise en charge peut être proposée même en l’absence de troubles de la fertilité ; elle permet d’éviter une IMG.
Le don de gamètes ou d’embryon est proposé aux couples présentant un risque élevé d’avoir un enfant atteint d’une maladie dont l’anomalie génétique causale n’est pas identifiée, ou lorsqu’il existe des troubles de la fertilité.
Le médecin traitant étant un interlocuteur privilégié pour chaque patient, il serait recommandé, en cas de projet parental d’un couple, d’interroger les deux conjoints sur leurs antécédents familiaux en remontant au minimum jusqu'aux cousins et grands-parents et de demander si des membres de la famille ont déjà eu une consultation en génétique. Le cas échéant, le couple pourra être adressé en consultation de conseil génétique.
Contexte de consanguinité
Une question importante est de demander s’il existe un lien de parenté entre les conjoints. Le risque de transmettre une maladie génétique autosomique récessive est d’autant plus élevé que leur lien de parenté est proche. Certains services de génétique proposent des consultations et/ou des analyses génétiques pour les couples avec un lien de parenté. Il n’est jamais possible d’exclure un risque pour toutes les maladies autosomiques récessives, mais, dans certains centres, la recherche de statut hétérozygote pour les maladies autosomiques récessives les plus fréquentes peut être proposée (par exemple, l’amyotrophie spinale infantile, la mucoviscidose et certaines hémoglobinopathies).
À ce jour en France, contrairement à d’autres pays comme la Belgique, il n’est pas possible de pratiquer un diagnostic génétique préconceptionnel (DGPC) pour des couples sans antécédents familiaux de pathologies génétiques. Le comité consultatif national d’éthique (CCNE) s’est prononcé en faveur d’une étude pilote en France, mais les législateurs n’ont pas retenu cette proposition pour l’instant.
Pathologies génétiques liées aux « origines géographiques »
Environ 10 % des personnes d’origine subsaharienne sont hétérozygotes pour un variant du gène de la bêta-globine (sous-unité bêta de l’hémoglobine) responsable de l’hémoglobine S. Les patients homozygotes souffrent de drépanocytose. Il y a un intérêt à prescrire une électrophorèse de l’hémoglobine aux patients d’origine subsaharienne et les adresser en consultation de génétique si l’un des deux ou les deux ont une hémoglobine modifiée. Cet examen est souvent prescrit par la sage-femme ou le gynécologue durant la grossesse, mais à un terme déjà avancé, laissant peu de temps de réflexion et de possibilité aux couples pour la grossesse en cours. En effet, un diagnostic prénatal ou préimplantatoire peut leur être proposé s’ils ne souhaitent pas transmettre une forme sévère de la maladie.
Cas particulier du diagnostic présymptomatique
Le diagnostic présymptomatique (DPS) peut être proposé à une personne asymptomatique qui souhaite connaître son statut génétique concernant une pathologie préalablement identifiée dans sa famille, de transmission autosomique dominante le plus souvent (Figure 2).
La pratique du DPS est encadrée par la loi8. Elle doit être effectuée par un médecin oeuvrant au sein d'une équipe pluridisciplinaire rassemblant des compétences cliniques et génétiques. Cette équipe doit être dotée d'un protocole type de prise en charge et être déclarée au ministre chargé de la santé selon des modalités fixées par arrêté. Ces études génétiques ne peuvent donc légalement pas être prescrites par un médecin généraliste exerçant à son cabinet.
La prise en charge du patient se déroule généralement en plusieurs étapes :
- Une consultation d’information, notamment sur la pathologie familiale, le risque d’être porteur du variant pathogène familial, le suivi en fonction du statut génétique et le mode de transmission. L’équipe doit s’assurer de la bonne préparation et de l’accompagnement de la personne qui envisage un diagnostic présymptomatique.
- Suivant la pathologie et le contexte familial, la consultation peut être assurée par un médecin généticien ou un conseiller en génétique ou en deux temps avec un spécialiste d’organe. Par exemple, une consultation de neurologie et de génétique sont prévues pour les maladies neurodégénératives telles que la maladie de Huntington. Un (ou plusieurs) entretien(s) avec un psychologue est vivement recommandé dans la plupart des cas et imposé dans le cadre des maladies neurodégénératives. Cet échange permet de mettre en perspective les potentielles conséquences personnelles et professionnelles pour la personne consultante et l’aide à mesurer l’intérêt ou non de connaître son statut génétique au moment où elle consulte.
- Après information et un délai de réflexion, la personne consultante décide de réaliser ou non la prise de sang afin de connaître son statut génétique. Le résultat est communiqué par le prescripteur à la personne, le plus souvent dans le cadre d’une consultation individuelle et en présence d’une psychologue suivant le contexte. La personne consultante est libre, à chaque étape, de prendre un temps de réflexion ou d’arrêter la démarche.
Information à la parentèle
Les résultats des examens des caractéristiques génétiques d’une personne peuvent également concerner ses apparentés. La loi précise l’importance de l’information à la parentèle : « Le médecin prescripteur informe la personne des risques qu'un silence ferait courir aux membres de sa famille potentiellement concernés si une anomalie génétique pouvant être responsable d'une affection grave justifiant de mesures de prévention, y compris de conseil génétique, ou de soins était diagnostiquée. Il prévoit avec elle, dans un document écrit qui peut, le cas échéant, être complété après le diagnostic, les modalités de l'information destinée aux membres de la famille potentiellement concernés afin d'en préparer l'éventuelle transmission. »9
La transmission de l’information à la parentèle par le patient lui-même est privilégiée même si le prescripteur peut l’y aider si besoin. En cas de rupture de contact au sein de la famille, le patient peut donner l’autorisation, par écrit, au prescripteur de transmettre un courrier aux membres de sa famille potentiellement concernés par le biais de la procédure de l’information médicale à caractère familial, en lui remettant les coordonnées des apparentés à prévenir. Le courrier ne mentionne ni le nom de la personne concernée, ni le nom de la pathologie.
Si le patient refuse d’informer ses apparentés par l’un de ces moyens, il est informé du risque qu’il encourt pour sa responsabilité civile.
Le prescripteur a peu de moyens pour vérifier si l’information à la parentèle est bien transmise au sein d’une même famille. Les médecins assurant le suivi peuvent poser la question au patient lors des rendez-vous médicaux pour s’en assurer et l’y aider si besoin.
Dépistage de maladies génétiques par les médecins traitants, quand adresser ?
Dans le cas de pathologies fréquentes pour lesquelles il existe des examens biologiques de dépistage, un bilan biologique peut être prescrit par le médecin traitant, ou le spécialiste d’organe, et, en fonction du résultat, un avis peut être pris auprès d’un service de génétique10.
On peut citer par exemple le cas de l’hémochromatose (qui atteint 1 personne sur 250), le portage hétérozygote pour la drépanocytose dans les populations d’origine subsaharienne (cf. supra) ou le déficit en alpha-1 antitrypsine.
À l’inverse, il n’y a pas d’intérêt médical à rechercher le statut génétique des apparentés sains d’une personne porteuse de l’antigène HLA-B27.
Prédisposition génétique
Certaines pathologies plus communes peuvent être favorisées par une prédisposition génétique, comme la maladie d’Alzheimer, ou certains cancers11. L’histoire clinique du patient et/ou les antécédents familiaux sont des éléments à prendre en compte pour y penser tels que :
- La précocité de l’âge de survenue,
- L’excès de cas dans la même branche parentale,
- L’atteinte bilatérale et multifocales pour les organes doubles dans le cas du cancer.
Si les personnes atteintes sont encore vivantes, il faut se rapprocher du patient et du spécialiste qui la suit pour déterminer l'indication d’une consultation de génétique ou d’oncogénétique.
Si la personne atteinte est décédée ou refuse la consultation de génétique, le généraliste pourra interroger le service de génétique ou d’oncogénétique de proximité en détaillant les liens de parenté et l’âge des diagnostics des personnes atteintes pour qu'il détermine s'il y a une indication ou non à recevoir le patient en consultation.
Des informations utiles sur des pathologies génétiques ou pouvant être liées à une prédisposition génétique sont disponibles pour le médecin traitant, notamment concernant le conseil génétique, sur le site Orphanet (https://www.orpha.net/) ou sur le site de la Haute auto-rité de santé où de plus en plus de Protocoles nationaux de diagnostic et de soins (PNDS) sont disponibles (https://www.has-sante.fr/jcms/c_1340879/fr/protocolesnationaux-de-diagnostic-et-de-soins-pnds).
Enjeux liés au séquençage à très haut débit
Dépistage néonatal
Actuellement, 13 maladies rares font l’objet d’un dépistage néonatal par le test de Guthrie.

Tableau 1 : Maladies dépistées grâce au test de Guthrie.
Le dépistage néonatal est mis en place pour diagnostiquer des enfants atteints de ces pathologies, mais les techniques utilisées dépistent également des enfants sains qui sont seulement hétérozygotes, de façon constante pour la drépanocytose et de manière inconstante pour la mucoviscidose. Ceci permet d’établir un conseil génétique pour les parents et les membres de leur famille. Ainsi, selon les centres de dépistage, ces couples peuvent être informés de ce statut par courrier ou par le Centre de ressources et de compétence pour la mucoviscidose (CRCM). Il leur est alors recommandé une consultation de conseil génétique pour que ce résultat leur soit expliqué et qu’une analyse génétique de confirmation leur soit proposée. Si des couples interrogent leur généraliste sur le courrier qu’ils ont pu recevoir, il peut les rassurer sur le fait que leur enfant est sain et les inviter à prendre rendez-vous en consultation de conseil génétique comme recommandé. Ce rendez-vous permettra de leur expliquer le statut d’hétérozygote de leur enfant, leur proposer une analyse génétique pour vérifier quel est le parent porteur du variant génétique identifié et ainsi effectuer l’enquête familiale de son côté. Cela permet également de vérifier que les deux parents ne sont pas hétérozygotes, car, si tel était le cas, le couple aurait un risque de transmission de la pathologie lors d’un prochain projet parental. Ils seront également informés sur les prises en charge qui peuvent être proposées. Concernant le statut de cet enfant hétérozygote, il est recommandé que cette donnée soit bien notifiée dans son dossier pour que cette information ne se perde pas à l’âge adulte lorsqu’il aura son propre projet parental.
La révision de la loi de bioéthique autorise maintenant les études génétiques en première intention pour le dépistage néonatal, alors qu’elles n’étaient proposées qu’après un dosage biochimique pour les pathologies dépistées jusqu’à présent. Ceci permet d’élargir les pathologies dépistables qui n’auraient pas de biomarqueurs permettant de les diagnostiquer facilement. Actuellement, des études pilotes sont menées en région Pays de la Loire pour le dépistage des déficits immunitaires combinés sévères et en régions Nouvelle-Aquitaine et Grand Est pour le dépistage de l’amyotrophie spinale infantile. L’extension du dépistage de ces pathologies à l’ensemble du territoire devrait être effectuée courant 2025.
Données incidentes
La probabilité de découvrir fortuitement une anomalie génétique n’ayant pas de rapport avec la cause génétique recherchée, appelée donnée incidente, est plus importante sur une étude de génome qu’avec des techniques plus ciblées et nécessite qu’une information adaptée soit délivrée au patient à ce sujet avant l’analyse génétique. On mesure toute la complexité de pouvoir recueillir le consentement éclairé des patients pour une question aussi vaste et complexe. Des discussions sont en cours afin de déterminer les modalités d’application de la loi. Précisons également qu’en conséquence de l’identification d’une prédisposition génétique à une pathologie pour laquelle existent des mesures de prévention ou de soins, les apparentés devront légalement être informés.
Les tests génétiques en accès libre
Profitant des coûts abordables du séquençage à très haut débit, des sociétés privées proposent des tests génétiques en accès libre sur internet, notamment pour apporter un conseil génétique. Ces analyses sont strictement interdites en France et la protection des données sensibles des caractéristiques génétiques ainsi que la fiabilité de ces tests laissent à désirer. Une mise en garde sur l’utilisation de ces tests est importante à relayer par le médecin traitant12,13.
Conclusion / Perspectives
CE QUE NOUS FAISONS
Une consultation de génétique est proposée aux apparentés qui sont à risque de transmettre une pathologie génétique ou de la développer eux-mêmes en respectant l’encadrement légal de la prescription des analyses génétiques. En cas de projet parental, un diagnostic prénatal ou préimplantatoire peut être proposé si la pathologie relève de cette indication.
CE QUI CHANGE
Le séquençage à très haut débit permet de réduire sensiblement l’impasse diagnostique pour de nombreux patients et de porter des diagnostics plus précocement, offrant des possibilités de conseil génétique dans les familles et une amélioration de la prise en charge. L’étude du génome d’un patient permet également d’avoir accès à d’autres informations génétiques, telles que les données incidentes, et pose la question de savoir ce que le patient souhaite véritablement connaître ou non, et s’il a bien compris les conséquences potentielles de l’analyse génétique lors du recueil de son consentement.
CE QUE NOUS FERONS
Le développement du séquençage du génome à moindre coût permet d’envisager des études génétiques en population générale dans un objectif de dépistage tel que le dépistage néonatal ou le diagnostic génétique préconceptionnel portant sur des centaines de pathologies génétiques. Des études de recherche sont en développement en France afin de répondre aux questions de faisabilité et d’utilité clinique ainsi que de mesurer les enjeux psychosociaux, éthiques et économiques que ces projets peuvent soulever.
*Laura Guyon1,† / Alice Yvard1,† / Sandra Mercier1,2
1 CHU Nantes, Service de génétique médicale, Nantes, France.
2 Nantes Université, CNRS, INSERM, l'institut du thorax, Nantes, France
† Les auteurs ont contribué à parts égales à la rédaction de l’article.
Les auteurs déclarent n’avoir aucun lien d’intérêt lié au contenu de cet article.
Remerciements
Les auteurs remercient très sincèrement leurs collègues du service de génétique médicale du CHU de Nantes pour leur relecture : les Drs Marie Vincent, Solène Conrad, Mathilde Nizon et le Pr Stéphane Bézieau.
Références
- https://www.filieresmaladiesrares.fr/
- Plan France médecine génomique 2025
(https://pfmg2025.aviesan.fr/) - Traitement portant sur des catégories particulières de données à caractère personnel. Article 9, RGPD.
(https://www.cnil.fr/fr/reglement-europeen-protection-donnees) - CSP. Titre III : Examen des caractéristiques génétiques, identification par empreintes génétiques et profession de conseiller en génétique – Articles L1130-1 à L1133-10
(https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000043891788) - Loi n° 2021-1017 du 2 août 2021 relative à la bioéthique
(https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000043884384) - CSP Titre III : Examen des caractéristiques génétiques, identification par empreintes génétiques et profession de conseiller en génétique – Chapitre II Profession de conseiller en génétique (Articles L1132-1 à L1132-7)
(https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000043896220) - CSP. Chapitre III : Interruption de grossesse pratiquée pour motif médical - Article L2213-1
(https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000043896164) - CSP. Sous-section 1 : Dispositions générales – Article R1131-5
(https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000048870362) - CSP. Chapitre Ier : Modalités de mise en oeuvre des examens des caractéristiques génétiques et des identifications par empreintes génétiques et information de la parentèle - Articles L1131-1
(https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000043895837) - Annuaire des conseillers en génétique par région
(https://af-cg.fr/cg-par-region-2/) - Prédispositions génétiques au cancer et dispositif national d’oncogénétique
(https://www.e-cancer.fr/Professionnels-de-sante/L-organisation-de-l-offre-de-soins/Oncogenetiqueet-plateformes-de-genetique-moleculaire/Les-predispositions-genetiques) - Tests génétiques sur Internet : la CNIL appelle à la vigilance (Mars 2024) :
https://www.cnil.fr/fr/tests-genetiques-sur-internet-la-cnil-appelle-la-vigilance - 13. Méfiez-vous des tests génétiques récréatifs en ligne ! Filière AnDDIRares, DataSanté
https://www.youtube.com/watch?v=ScPwS7ew4Ao

